
2023年3月7日,來自俄羅斯科學(xué)院托木斯克國家醫(yī)學(xué)研究中心癌癥研究所癌癥進(jìn)展生物學(xué)實驗室��、托木斯克國立大學(xué)轉(zhuǎn)化細(xì)胞與分子生物醫(yī)學(xué)實驗室����、俄羅斯人民友誼大學(xué)分子與細(xì)胞醫(yī)學(xué)研究所單細(xì)胞生物學(xué)實驗室等機(jī)構(gòu)的科學(xué)家們聯(lián)合在線發(fā)表了題為“Comparison of the Illumina NextSeq 2000 and GeneMind Genolab M sequencing platforms for spatial transcriptomics”的研究成果。該研究基于真邁生物的GenoLab M和Illumina的NextSeq 2000兩個測序平臺分別對3例卵巢癌樣本進(jìn)行10x?Genomics Visium空間轉(zhuǎn)錄組測序�,并對得到的測序數(shù)據(jù)進(jìn)行比較分析。研究發(fā)現(xiàn)GenoLab M在測序數(shù)據(jù)質(zhì)量方面的表現(xiàn)與NextSeq 2000不相伯仲��。在后續(xù)的降維分析�����、細(xì)胞亞群分析及差異表達(dá)基因方面也與NextSeq 2000分析結(jié)果均保持了高度的一致性��,證明其應(yīng)用于空間轉(zhuǎn)錄組的實力。
背景介紹
單細(xì)胞轉(zhuǎn)錄組測序(scRNA-seq)是在單個細(xì)胞水平進(jìn)行高通量轉(zhuǎn)錄組測序的一項新技術(shù)���,能夠有效解決細(xì)胞異質(zhì)性以及組織轉(zhuǎn)錄組測序(bulk RNA-seq)被掩蓋的細(xì)胞群內(nèi)轉(zhuǎn)錄組異質(zhì)性難題���。該技術(shù)有助于發(fā)現(xiàn)新的稀有細(xì)胞類型,深入了解細(xì)胞生長與分化過程中的表達(dá)調(diào)控機(jī)制���。然而�,在進(jìn)行scRNA-seq測序的細(xì)胞解離過程中不僅存在與細(xì)胞應(yīng)激�����、細(xì)胞死亡/細(xì)胞聚集等相關(guān)的阻礙因素�,同時還會丟失空間信息。此外����,一些組織中的特定細(xì)胞類型��,尤其是免疫細(xì)胞�,難以從組織中解離出來,更限制了scRNA-seq測序的廣泛應(yīng)用�����。技術(shù)更迭,空間轉(zhuǎn)錄組技術(shù)橫空出世�,更是在2020年被Nature Method評為年度技術(shù)。其中基于10X 單細(xì)胞平臺的空間轉(zhuǎn)錄組技術(shù)成為了主流��。該技術(shù)不僅能夠檢測完整組織切片的總mRNA���,而且還能將組織的空間信息和形態(tài)學(xué)內(nèi)容與mRNA整合在一起��,最終繪制出基因表達(dá)的空間位置信息����。為研究細(xì)胞功能��、細(xì)胞表型和組織微環(huán)境等提供了關(guān)鍵的信息���。
真邁生物的GenoLab M測序儀作為一個新的測序平臺���,在轉(zhuǎn)錄組與lncRNA測序、WGS和WES方面表現(xiàn)優(yōu)異���,是否可以應(yīng)用到空間轉(zhuǎn)錄組呢��?對此�����,研究使用3份卵巢癌樣本����,分別在GenoLab M與NextSeq 2000上完成空間轉(zhuǎn)錄組測序,比較兩個平臺測序結(jié)果的一致性����。
結(jié)果概要
01實驗設(shè)計與測序質(zhì)量
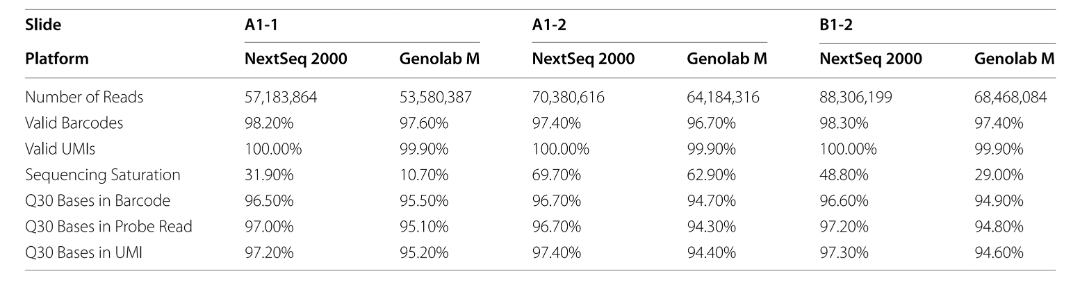 表1 三例卵巢癌樣本兩個測序平臺的測序質(zhì)量比較
表1 三例卵巢癌樣本兩個測序平臺的測序質(zhì)量比較
本研究將3份卵巢癌的石蠟切片樣本,分別構(gòu)建10xGenomics Visium的測序文庫�����。隨后將3個文庫一分為二���,分別使用GenoLab M與NextSeq 2000測序平臺進(jìn)行測序�����。2個平臺同一個樣本測序數(shù)據(jù)總量接近�����,NextSeq 2000中有效barcode的百分比和有效UMI的百分比分別高出GenoLab M 0.74%和0.1%��。而Q30堿基的百分比在barcode����、探針和UMI對比中也比GenoLab M分別高出1.6%����、2.2%和2.6%。以上的差異主要是GenoLab M測序數(shù)據(jù)深度與測序reads duplication相對較低�����。
* Barcode是含有空間位置標(biāo)簽的一段核酸序列��,區(qū)分不同的spots���,每個spots包含數(shù)十個細(xì)胞用于定位�;
* Probe探針是用于結(jié)合mRNA的的序列����;
* UMI是區(qū)分不同mRNA�����,用于絕對定量的核酸序列���;
02reads mapping與基因表達(dá)絕對定量
兩個平臺組織的spots下reads的比例基本一致,差異不顯著��。每個spots和組織的平均reads數(shù)與測序深度也基本一致�。除樣本B1-2外,GenoLab M平臺中每個spot的UMI計數(shù)和基因的中位數(shù)以及檢測到的基因數(shù)都比NextSeq 2000高���。而NextSeq 2000在Reads Mapped Confidently to Probe Set 的表現(xiàn)中略高于GenoLab M����。這與探針reads更高的測序質(zhì)量一致���。盡管如此���,在Reads Mapped Confidently to the Filtered Probe Set的對比中 GenoLab M仍然有比NextSeq 2000更好的表現(xiàn)。
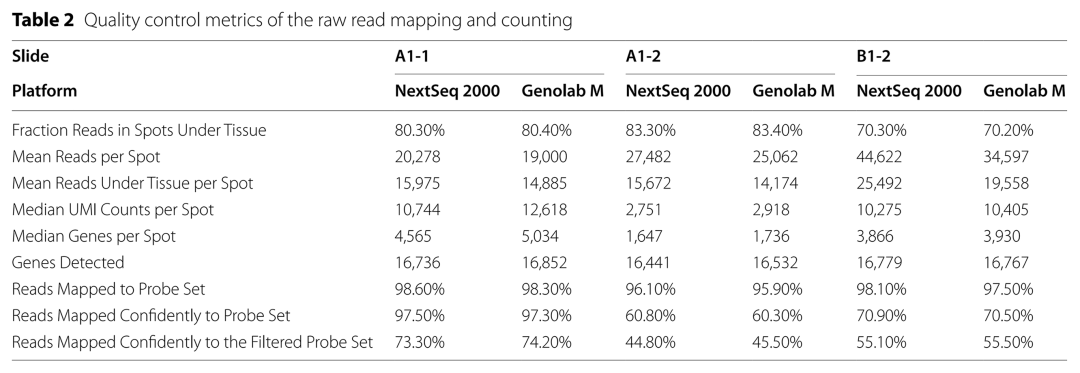 表2 reads mapping和UMI計數(shù)的測序質(zhì)量矩陣比較
表2 reads mapping和UMI計數(shù)的測序質(zhì)量矩陣比較
03基因�����、UMIs�����、reads在組織的spots上的檢測情況
兩個測序平臺組織的spots下總的UMI和基因數(shù)目具有很高的一致性(Figure 1A)��。三個樣本的基因-UMI關(guān)系在兩個平臺的一致性也很高(Figure 1B)���。此外,GC譜也高度一致(Figure 1C)�����,說明兩個測序平臺都沒有明顯的測序偏向性����。
接著研究者去除低表達(dá)基因和基因數(shù)目較少的spots后,比較兩個平臺的基因交并集情況。結(jié)果表明平臺特有基因相對于交集占比都比較小��,其中GenoLab M的特有基因稍多(Figure 1D)����。在兩個平臺上測序的spots基因交集之間存在很強(qiáng)的相關(guān)性。三個樣本A1-1�、A1-2 和 B1-2 樣本的平均相關(guān)系數(shù)分別為 0.82、0.90 和 0.99(Figure 1E)�。
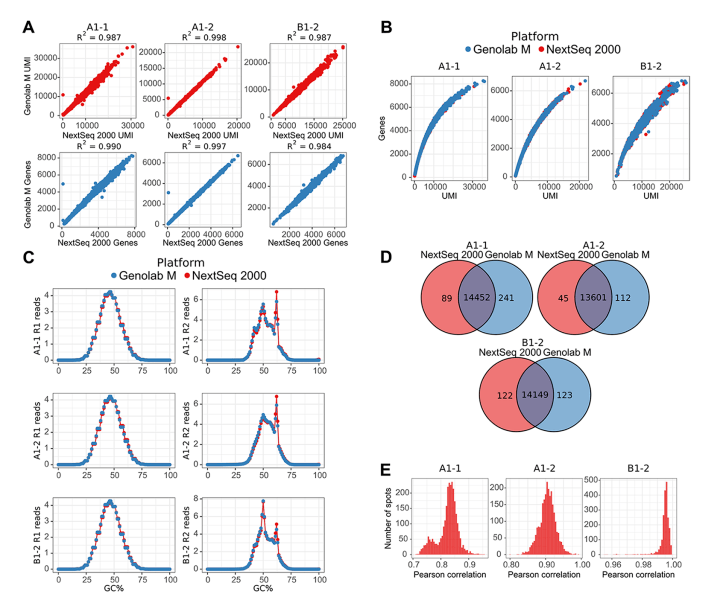 圖1 兩個測序平臺檢測到的reads數(shù)目,UMI和基因的比較
圖1 兩個測序平臺檢測到的reads數(shù)目,UMI和基因的比較
A 組織spots上轉(zhuǎn)錄本(基于UMI計數(shù))和基因數(shù)的一致性分析���;
B 組織spots上基因的UMI分布�;
C reads的GC含量譜����;
D 平臺間共有和特有基因的維恩圖;
E SCT轉(zhuǎn)化基因交集的Pearson相關(guān)系數(shù)分布���;
04降維�����、細(xì)胞亞群聚類和差異表達(dá)分析
三個樣本在兩個平臺的測序結(jié)果分析后得到的細(xì)胞亞群幾乎一致����,都是16個亞群(Figure 2A),來自不同測序平臺分析的樣本的組織spots所在的位置也非常接近(Figure 2B)����。A1-1含有7個亞群���、A1-2有4個亞群���、B1-2有5個亞群。差異表達(dá)基因(DEG)檢測方面��,NextSeq 2000和GenoLab M分別檢測到的特有DEG約占所有檢測的DEG的16%����;共有的占比更高為68%(Figure 2C-E)。
* DEG的篩選條件��,F(xiàn)DR<0.01且log fc='>0.25(差異倍數(shù)>1.19)���;
* FDR False Discovery Rate錯誤發(fā)現(xiàn)率���;
* LTF Log2(Fold Change) 差異倍數(shù)fold change的log2值����;
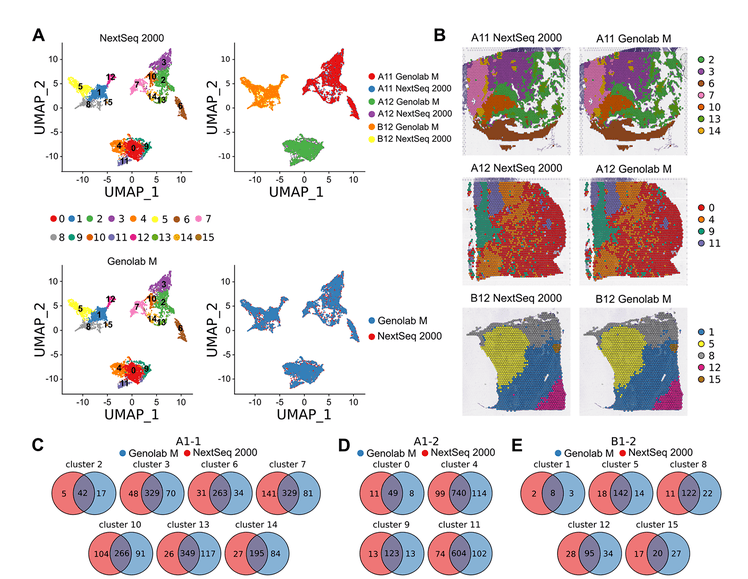 圖2 非線性降維�、聚類和差異表達(dá)分析
圖2 非線性降維�、聚類和差異表達(dá)分析
A 未做批次校正的兩個平臺的測序數(shù)據(jù)UMAP降維和聚類;
B 亞群的空間分布�����;
C A1-1樣本的平臺間共有與特有差異表達(dá)基因的維恩圖�;
D A1-2樣本的平臺間共有與特有差異表達(dá)基因的維恩圖;
E B1-2樣本的平臺間共有與特有差異表達(dá)基因的維恩圖���;
05差異表達(dá)基因的深入分析
研究對平臺共有與特有的DEG深入分析以評估特有DEG的來源��。通過DEG的計數(shù)來可視化LFC和FDR的分布�。圖3A展示了DEG-LFC在組織spots亞群聚類的分布����,發(fā)現(xiàn)所有平臺特有的DEG的LFC均分布在所選閾值的邊緣�。圖3B展示了DEG-FDR在組織spots亞群聚類的分布����,平臺特有DEG的FDR值往往最大(代表顯著性值最低)。綜合來說���,平臺特有DEG比較接近閾值�����,而共有的DEG則具有較小的FDR和較高的差異倍數(shù)。
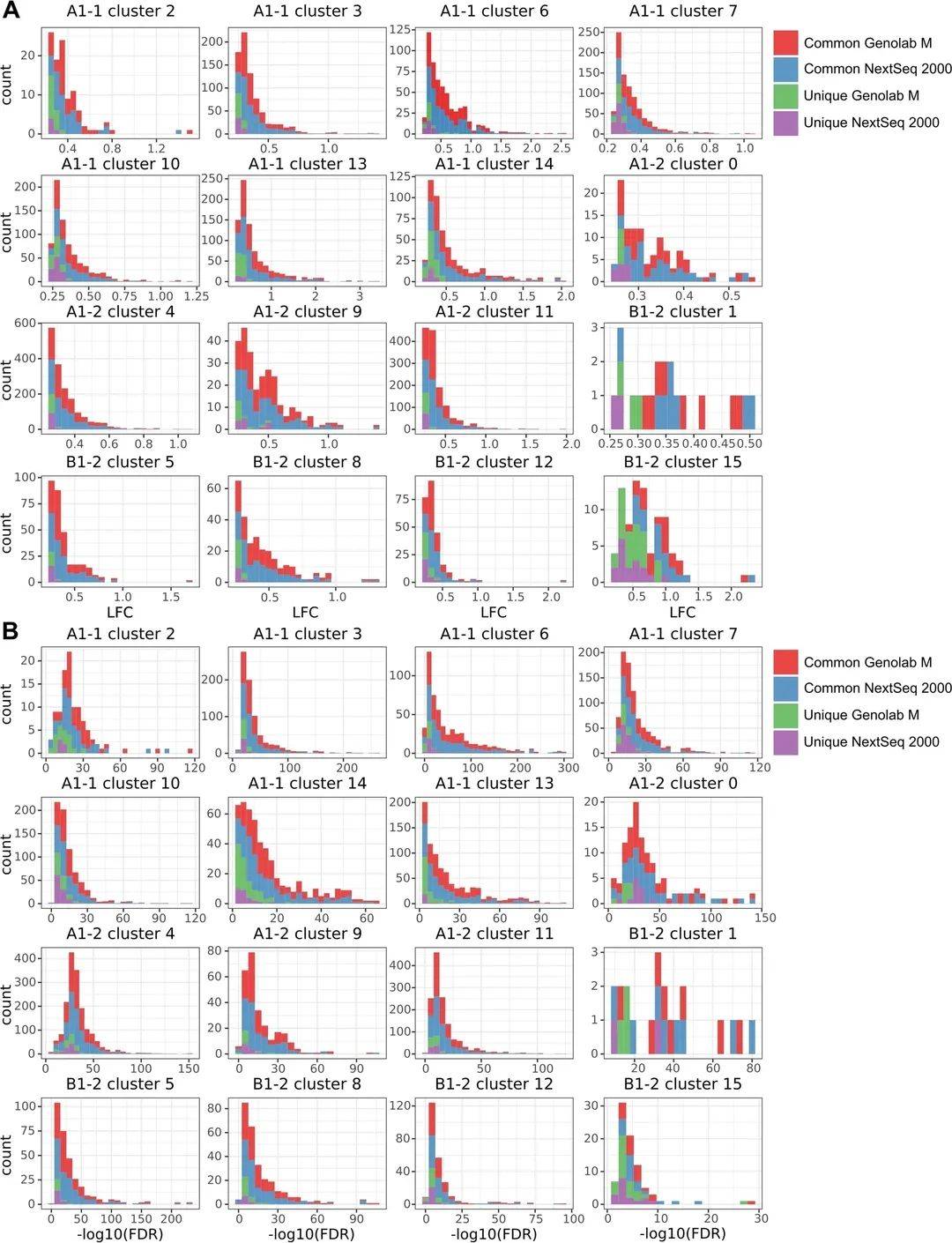 圖3 亞群差異表達(dá)的差異倍數(shù)(A)與FDR(B)的分布情況
圖3 亞群差異表達(dá)的差異倍數(shù)(A)與FDR(B)的分布情況
結(jié)論
研究首次比較了GenoLab M和NextSeq 2000在空間轉(zhuǎn)錄組測序的性能�,兩個平臺均采用了可逆終止的邊合成邊測序的技術(shù)。三份Visium的測序文庫在兩個測序平臺上得到了一致的空間轉(zhuǎn)錄組分析數(shù)據(jù)��。研究結(jié)果表明GenoLab M的測序性能與NextSeq 2000接近����,適用于進(jìn)行基于10?×?Genomics的空間轉(zhuǎn)錄組測序����。